Com a campanha de vacinação andando em Santa Maria com três diferentes vacinas (CoronaVac, AstraZeneca e Pfizer), a Sichuan Clover Biopharmaceuticals começou seus testes de um novo imunizante contra o coronavírus na cidade. Na Universidade Federal de Santa Maria (UFSM), serão mil voluntários para os testes, sendo que metade destes recebem duas doses da vacina avaliada na pesquisa Spectra. A outra metade recebe placebo.
O teste feito é o da fase 3, quando se avaliam a eficácia e a segurança. A vacina é feita a partir de uma combinação de antígenos em laboratório. É realizado o desenho da proteína do coronavírus, e o imunizante induz a formação de anticorpos contra aquela estrutura. Esta vacina da empresa Sichuan, com sede na China, a SCB-2019, também tem uma substância que potencializa a resposta imunológica do organismo, chamada de adjuvante.
A vacina consegue suportar a temperatura ambiente e também pode ser armazenada em refrigeradores comuns. Funciona em duas doses, com intervalo de aplicação entre a primeira e a segunda que varia de três a nove semanas.
O teste é feito no modelo "randomizado e duplo cego", ou seja, são escolhidos ao acaso os voluntários que recebem vacina e que recebem placebo. Nem voluntário nem médico responsável sabem quem recebeu qual. Nesta vacina, o placebo é soro fisiológico.
Em Santa Maria, as ações acontecem no Campus da UFSM em Camobi, em um dos prédios do Centro de Ciências da Saúde. Por dia, são agendados cerca de 60 voluntários, para evitar aglomeração de pessoas. Na terça-feira da semana passada (8), uma das voluntárias fui eu.
Antes de tudo, o voluntário recebe um documento explicando como se dá a pesquisa. É preciso rubricar cada uma das 10 páginas verdes impressas antes de fazer, de fato, parte do estudo. O documento detalha os riscos ao voluntário, a segurança dos testes, o que significam “duplo cego”, “randomizado” e outros termos. Também abre a possibilidade para permitir ou não o uso de seus materiais coletados, como o sangue, para outras pesquisas científicas. Com tudo assinado, a próxima etapa é a maior.
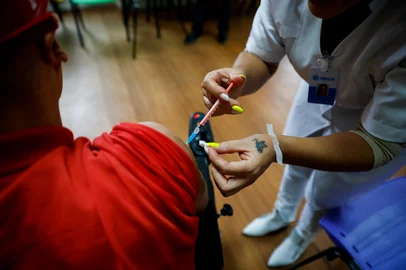
São realizadas conversas com médicos, bateria de exames, coleta de sangue, aplicação da primeira dose (da vacina ou do placebo), avaliação posterior e download do app que acompanha os voluntários. As esperas entre uma etapa e outra parecem pequenas, mas, ao todo, fiquei cerca de três horas no prédio.
Durante as trocas de salas, percebi nos olhos dos voluntários a pequena apreensão que eu sentia: eram muitos exames, algo poderia ser descoberto sobre nós mesmos. E se o teste de coronavírus resultar positivo? Ou o de gravidez? A pandemia pode ter nos deixado com pressão alta, a oxigenação do sangue pode não estar tão boa. Eram muitas possibilidades.
Mas a surpresa que encontramos – alguns voluntários e eu também, confesso – foi no cálculo de IMC. O comentário, não só no local mas também de outros voluntários que receberam a constatação, era de ter descoberto a situação de sobrepeso ou obesidade. “É a pandemia”, atestavam os acometidos. Felizmente, isso não nos impede de participar dos testes.
Saí de lá com o termo de consentimento, a primeira dose aplicada, o cartão com a data marcada para a próxima dose, dois kits de testes de coronavírus e um termômetro digital _ que vem em Fahrenheit, é preciso configurar a troca para Celsius.
Minha segunda aplicação está marcada para o fim do mês. Até lá, sigo aferindo minha temperatura e pensando diversas vezes se estou sentindo algum dos sintomas apontados no termo de consentimento — como dor, vermelhidão no local, mal-estar, febre, enjoo e etc — ou algo diferente. Afinal, a responsabilidade também é minha. A bula será feita a partir do que nós, os voluntários, percebermos ao longo do estudo.
Nas 48 horas após a aplicação, período que normalmente as reações são mais intensas, só senti dor no braço, no local da aplicação. E frio na barriga, claro, pela dúvida.
Quando falei que participaria da pesquisa, ouvi uma pergunta que é muito válida: é hora para participar de testes de nova vacina, que tem duração de 13 meses e é chamada duplo cego, ou seja, só saberei se estou imunizada ou não em julho de 2022, quando há projeções indicando que, por idade, posso me vacinar em setembro de 2021, com produto já testado e aprovado? A primeira resposta é o sentimento de fazer parte e auxiliar, da maneira que posso, na busca por soluções para a pandemia. A segunda vem do termo de consentimento que assinei. Diz que lá que, caso chegue a minha vez na fila, será feita a quebra do sigilo e eu saberei se estou vacinada ou não. Em caso de ter recebido duas doses de soro fisiológico, também terei a oferta de receber oficialmente a vacina da Spectra, nome do estudo feito pela farmacêutica chinesa Sichuan.
Este foi o sexto teste de vacina contra o coronavírus autorizado pela Anvisa. As demais foram os imunizantes da Universidade de Oxford/AstraZeneca, CoronaVac, Pfizer/BioNTech, Janssen-Cilag (Johnson & Johnson) e Medicago/GSK. Após esta, foi aprovado também o teste da Covaxin (Bharat Biontech). Até agora, já são usadas na campanha nacional a CoronaVac, a Astrazeneca e a Pfizer. Até o fim do mês, chegam ao Brasil também doses da Janssen.